ВНИМАНИЕ! ЭКСПЕРИМЕНТ!
Экспериментальные исследования in vitro по голографическому отображению и переносу ДНК в комплексе с информацией, ее окружающей Терапевт, №10, стр. 24-37 (2007) В этой работе мы показываем, что воздействие на препарат ДНК in vitro определенными сочетаниями электромагнитных полей в диапазоне УФ-ИК вызывает ответ в форме многообразных, динамичных, долгоживущих реплицирующихся голографических отображений ДНК и ее ближайшего окружения.
English versionМы обнаружили способность препаратов ДНК in vitro давать многократно реплицирующиеся отклики-отображения, реплики самой ДНК и ее ближайшего окружения. Такие реплики являются откликом на определенные комбинации воздействия электромагнитных полей в диапазоне УФ-ИК. Реплики могут выстраиваться строго по горизонтали в обе стороны, двигаться по сложным траекториям, а также сохраняться какое-то время после прекращения воздействия полей на препарат ДНК. (Рис.1-4).

Рис.1. Эффект волнового реплицирования ДНК и ближних окружающих предметов. Слева контроль, справа опыт. Второй вариант методов выявления волновых реплик ДНК.

Рис.2 (a). Дискретность и сложность траектории волновых реплик ДНК. (слева – исходное изображение, справа – контрастированное). Первый вариант методов выявления волновых реплик ДНК.

Рис.2 (б). Распределение яркостей изображения по каналам цветности: красный (R), зеленый (G), синий (B).

Рис.3 (a). Пространственная динамичность волновых реплик ДНК. Видна тонкая продольная структура траектории трека.
| Увеличить >>> | Увеличить >>> | Увеличить >>> |
Рис 3 (б).Распределение яркостей по каналам цветности: красный (R), зеленый (G), синий (B).
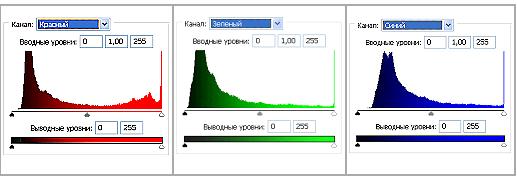
Рис 3.2. Гистограммы значений яркостей по каналам цветности: красный, зеленый, синий.На контрольных снимках, когда источники воздействующих на биопрепарат физических полей не включены, данного явления не наблюдается. Также как нет эффектов при действующей аппаратуре, но без ДНК. За время экспозиции (1 сек.) в первом варианте экспериментов (см. Методы) волновые реплики ДНК перемещаются в пространстве и мультиплицируются, их траектория не предсказуема и дискретна. Генерация реплик происходит только при условии взаимной пространственной стационарности препарата ДНК, источников возбуждающих полей и фотоаппарата. Прикосновение к препарату ДНК (второй вариант экспериментов) вызывает изменение вектора распространения реплик в пространстве на диаметрально противоположное (слева направо), а затем исчезновение (Рис.5 (а, б, в)). Существенно, что в ряде случаев имеет место не только волновое мультиреплицирование препарата ДНК, но и окружающих предметов (Рис. 1, 5 (а, б)).Для анализа цветного отпечатка на эмульсии фотопленки приведены изображения, полученные при сканировании пленки, как распределение яркостей в разных каналах цветности: красном (R), зеленом (G), синем (B): на Рис. 2(б), 3(б), 4(б). В изображении, представленном на Рис. 2 (а, б), видно, что почти вся яркостная шкала изображения реплик находится в красном канале цветности, в зеленом и синем они слабо различимы. Такое же превалирование яркостного диапазона красного канала хорошо видно на сопровождающих Рис.3 (б) гистограммах яркостей (Рис. 3 (в)) соответствующих каналов. Обращает на себя внимание именно та часть гистограммы, где расположено реплицированное изображение: участок яркостей в диапазоне значений от 128 до 255 – хорошо отличаемый пик значений в этой части гистограммы красного по сравнению с почти равномерным убыванием в такой же области гистограмм зеленого и синего каналов. Возможно, такое распределение яркостей может указывать на то, что сфотографированный дискретный трек есть опосредованная препаратом ДНК многократно повторенная реплика световой матрицы аппарата «Дюна-М» красного и инфракрасного цветов (позиция 8 на Рис. 8), на которой находится препарат ДНК в момент генерации реплик. Этот источник света представляет матрицу из 37 чередующихся диодов, из них красных – 21, инфракрасных – 16. В эксперименте препарат ДНК был помещен в пробирку эппендорф и перекрывал 5 диодов. Это коррелирует с 5-кратной продольной исчерченностью трека реплики (Рис. 3a).Важным свойством волновых реплик ДНК является относительная долговременность их существования после выключения всех инициирующих физических полей (Рис. 4), но время жизни реплик может зависеть также от чувствительности фотопленки, фиксирующей реплики. А также от ее спектральной избирательности.
| Рис. 4 (a). Волновая долгоживущая реплика ДНК из эксперимента на Рис. 3 («фантом») после выключения возбуждающих электромагнитных полей. |

Рис. 4 (б). Распределение яркостей по каналам цветности: красный, зеленый, синий.
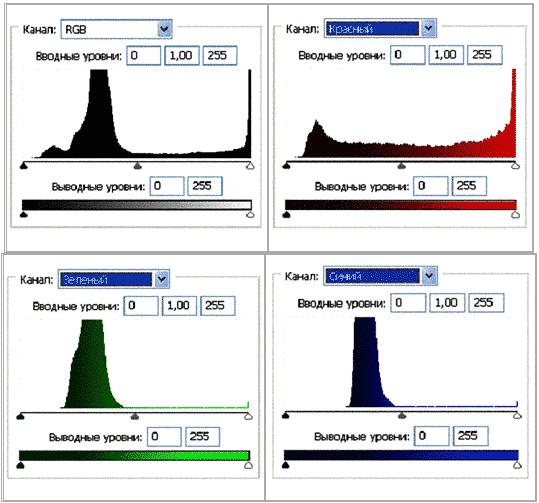
Рис. 4 (в).Гистограммы. Распределение яркостей по каналам цветности: красный, зеленый, синий.Первая слева в верхнем ряду: гистограмма RGB – общая (совмещенная).Можно заметить существенное отличие в распределениях яркостей по каналам цветности у изображения волновой реплики ДНК и «фантома» этой реплики, остающегося после выключения источников света. Анализ изображений на Рис. 4 (б) и сопоставление его с гистограммой на Рис.4 (в) выявляет то, что изображение «фантома» реплики в красном канале становится размытым как по диапазону, так и по амплитудам значений яркостей. При этом в зеленом и синем каналах наблюдается сужение локализации значений в диапазоне от 70 до 120, виден четкий пик, что объясняет яркость реплики ДНК, ее оттенки и полутона, особенно, в зеленом канале.

Рис.5 (а). Момент механического воздействия на препарат ДНК. Второй вариант методов выявления волновых реплик ДНК.Рис. 5 (б). Сдвиг волновых реплик налево сразу после механического воздействия. Характерно появившееся резкое деление кадра по свето- и цветопередаче, не связанные со стабильной работой шторки фотоаппарата.

Рис. 5 (в). Исчезновение эффекта образования реплик ДНК через 5-8 сек. после механического воздействия на препарат ДНК. При этом вся аппаратура, инициирующая реплики, остается включенной.Тип образующихся реплик в каждом конкретном случае в рамках используемых методов стохастический (1-й вариант методов) или детерминированный (2-й вариант) в пространстве-времени.Одним из результатов по индуцированию волновых реплик окружающих предметов с помощью препарата ДНК по первому методу явилось мультиплицирование тройного изображения лампы БС (УФ-В) (Рис. 6).
| Рис.6(а). Мультиплицирование тройного изображения лампы БС. Оригинал. | Рис.6(b). Мультиплицирование тройного изображения лампы БС. Контрастированное изображение. |
В качестве одного из контролей на способность генерировать волновые реплики использовали хлорид натрия (кристаллический); хлорид натрия (1М водный раствор); винная кислота в кристаллах; винная кислота рацемат (1М водный раствор); крахмал воздушно сухой; глицин кристаллический; кальциферол воздушно сухой; токоферол воздушно сухой; хлорофилл воздушно сухой; вода бидистиллированная; интерферон в смеси с Bacillus subtilis, воздушно сухие. Ни один из препаратов не дал реплик.

Одна из модификаций эксперимента, приведенного на Рис.5 (старый образец ДНК заменен свежим). Кадры фотопленки 3 и 4. На 4-м кадре видны реплики диодов «Дюны», уходящие направо. Характерно появление реплик перфорации и «засветок» вблизи их.

Кадры 11 и 12. С 4-го по 11-й кадр реплики диодов «Дюны» отсутствуют, но на 12-м кадре вновь появляются.

Кадры 13 и 14. На 13-м видны реплики диодов «Дюны» с характерным заходом в запретную зону межкадрового пространства. На 14-м кадре реплики вновь исчезают.

Кадры 23 и 24. С 14 по 22 реплики вновь исчезают, но слабо проявляются на 23 и 34 кадрах.Методы
Рис. 7. Матрица с красными и инфракрасными диодами (аппарат «Дюна М» или «ДюнаТ».
http://argonet.ru/nar_lechebn_duna.htm)
Содержит 37 диодов, из них красных – 21 ( = 650нм), инфракрасных – 16 ( = 920нм).
Мы использовали две схемы экспериментов. Первая приведена на (Рис.9), вторая достаточно проста и видна напрямую на фото (Рис. 5(в)). Схемы также даны в18. Для получения и визуализации волновых репликативных отображений ДНК по первой схеме производят следующие операции. Посредством реле времени (позиция 3 на Рис.8) в разных сочетаниях включаются необходимые излучатели БС (УФ-В, представляющий лампу накаливания синего цвета «ЛОН БС 75», из стекла СЛ98-1) (позиция 5) и матрица с красными и инфракрасными диодами (Рис. 8)) (позиция 8 на схеме Рис. 8), а также лампа ртутная бактерицидная, или лампа Compact electronic CEST26E27 Black (УФ-С) (позиция 6), или БС (УФ-В) и МХТ-90 (холодный катод (позиция 4)). При включении источников света воздушно сухой препарат ДНК из селезенки быка (РЕАХИМ, марка А, НПО «Биолар») (около 100 мг в закрытой пластиковой конической пробирке «эппендорф» длиной 4см, диаметром в верхней части 0,9см) или (3мл водного раствора ДНК, 1мг/мл) находится в зоне действия излучателей (1мм-50см от источников света). Ход работы снимается на фотоплёнку Fuji 24-27 DIN. При этом работает осциллограф (позиция 2) с электродами, которые регистрируют электромагнитные поля в зоне проведения эксперимента и фиксируется усреднённый нормальный электромагнитный фон в помещении, определяемый по характеру синусоиды на осциллографе. Далее посредством реле времени через 10 мин. отключают излучатель УФ-С. Фотографически обнаруживается возникновение динамичных специфических волновых структур, невидимых глазами, но фиксируемых на фотопленке мультиплицированных реплик ДНК и ближних окружающих объектов, непосредственно связанных с фотонным воздействием на ДНК. Иначе говоря, происходит умножение количества отображений препарата ДНК, распределяемых в пространстве по сложным траекториям (1-й вариант методов) и по горизонтали (2-й вариант методов), а также отображений объектов, связанных с возбуждением ДНК.Второй вариант методов получения и визуализации волновых репликативных отображений ДНК (Рис. 5(в)) состоит в следующем. Воздушно сухой препарат ДНК, 100мг, помещают в открытом виде в держатель из алюминиевой фольги. С интервалом 2-3 сек. включают лампу БС (УФ-В), лампу сompact electronic CEST26E27 Black (УФ-С) и аппарат «Дюна М». Через 5 мин. начинают фотосъемку. В этом варианте регистрируются реплики ДНК и ближних объектов, которые распространяются строго направо. При механическом воздействии на препарат ДНК вектор распространения реплик меняет своё направление на диаметрально противоположное, то есть налево. Затем через 5-8 сек. после механического воздействия, несмотря на то, что вся аппаратура, инициирующая реплики, остается включенной, реплики исчезают (или не фиксируются используемым типом фотопленки).
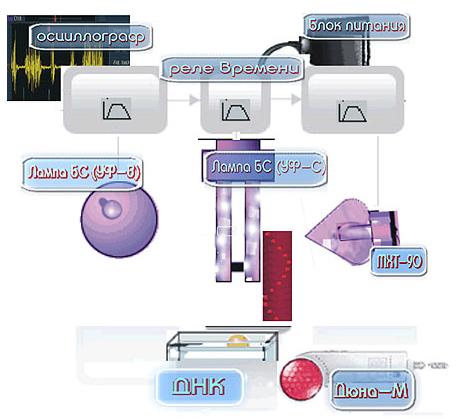
Рис. 8.
Обсуждение
Несмотря на успехи молекулярной генетики и клеточной биологии, до сих пор тонкие механизмы знаковых функций генетического аппарата остаются непонятными. Особенно ярко это проявилось после публикации работы, в которой команде Pruitt удалось изящно доказать, что законы Менделя в генетике не всегда выполняются, более того, поведение одного из генов не подчиняется здравому смыслу1. Это проявилось в том, что во взрослых растениях Arabidopsis фенотипически проявился нормальный ген Hothead, которого не было в исходных мутантных по этому гену семенах. Нормальный ген Hothead был у предков растения. Отсутствующий в хромосомах посеянных семян ген Hothead в 10% случаев заменил реальный мутантный ген hothead, когда эти семена дали взрослые растения. Объяснения этому феномену пока не дано. Высказано предположение, что нормальный ген хранился как его ревертазная РНК копия. Это слабое и уязвимое объяснение, не имеющее экспериментального доказательства. Необъяснимый с позиций классической генетики феномен возврата предкового гена поднял на поверхность целый ряд нерешенных кардинальных вопросов генетики и эмбриологии. Их можно кратко перечислить:a/ воблирование 3-го нуклеотида в кодоне делает каноническую таблицу генетического кода ареной потенциальных ошибок в синтезе белков поскольку она автоматически даёт омонимии значащих дублетов в кодонах, когда пары одинаковых дублетов кодируют разные аминокислоты2; при этом третьим нуклеотидом кодона может быть любой из четырех, что постулировал F.Крик3; тем не менее, ошибки при выборе аминокислот чрезвычайно маловероятны, и это удивительный факт; b/ ситуация, когда 98% генома эукариот считают «мусором», в лучшем случае, помощником триплетного кода, или «кладбищем» вирусных геномов; c/ 2% кодирующей ДНК человека (около 40тыс. генов) оказалась весьма близкими таковым свиней, ослов, мух и даже E.coli; d/ гены по непонятным причинам и законам транспозицируются в 3-D континууме хромосом; e/ гены по непонятным причинам разбиты на интроны и экзоны; f/ матрично независимый синтез РНК последовательностей Qβ-репликазой бактериофага E.coli и такой же синтез РНК последовательностей РНК полимеразой бактериофага T7 E. coli4,5, которые нарушает канонический принцип чисто вещественной репликации ДНК РНК; g/ фантомный листовой эффект, когда часть живого листа растения воспроизводит его целый образ в режиме газо-разрядной (Кирлиановской) визуализации6,7; h/ непонятные по механизмам дистантные функции селекторных генов морфогенеза, когда их продукты синтезируются в одном месте, а действие сразу проявляется в другом, далеко отстоящем месте развивающегося эмбриона.Все эти и другие мало понимаемые проявления знаковых функций хромосом заставляют думать и доказывать, что генетическая память имеет иные атрибуты, существенно дополняющие белковый код. Вероятно, эти атрибуты имеют волновую природу. Именно эти противоречия и неполнота модели триплетного белкового кода для объяснения кодирования пространственно-временной структуры многоклеточных биосистем заставила нас обратить внимание на работу генетического аппарата как системы высоко организованных знаковых излучений электромагнитных и акустических полей8,9,10,11. Вероятно, одним из проявлений волновых знаковых функций ДНК являются обсуждаемые здесь результаты нашего исследования по волновым репликам ДНК. Первые свидетельства, что ДНК способна к волновому типу памяти были получены нами в 1985г. Мы обнаружили феномен так называемой ДНК фантомной памяти (DNA phantom effect)12и подробно описали его в работе8. Возможно, он имеет прямое отношение к излагаемым здесь результатам. ДНК фантомный эффект проявляется следующим образом. При работе с ДНК, как линейным полимером, с использованием метода динамического лазерного светорассеяния (ДЛС), в кюветном отделении спектрометра остаются некие гипотетические структуры (объекты), специфическим образом рассеивающие свет после удаления кюветы с препаратом ДНК. Именно это явление было названо ‘DNA phantom effect’. Контрольные замеры, до помещения ДНК в спектрометр, дают только фоновое светорассеяние. Продувание кюветного отделения прибора газообразным азотом приводит к исчезновению фантома, однако он вновь регистрируется спустя 5-7 минут. Фактически близкий эффект наблюдали Allison et. al.13, которые также использовали ДЛС для изучения рестриктных фрагментов ДНК. Они обнаружили аномальное светорассеяние таких фрагментов. Авторы определили этот феномен как ‘mimicking the effect of dust’, то ест как эффект, имитирующий пыль. В их исследовании этот эффект не являлся результатом пылевых загрязнений, но следствием влияния ‘объекта’, который вел себя как пылеподобные ‘частицы’, рассеивающие свет. Поведение таких ‘частиц’ задает такие характеристики светорассеяния, которые не согласуются с классическими моделями процесса светорассеяния для линейных полимеров14,15,16. Между экспериментами8,12,13есть общие моменты, связанные с тем, что на препараты ДНК воздействовали светом в видимой области – 632,8нм и 488нм. То же самое имеет место при инициации волновых реплик ДНК в данной работе. В образовании волновых реплик ДНК доминирующую функцию берёт на себя, вероятно, тот излучатель, длина волны которого совпадает с длиной волны поглощения ДНК. Это источник УФ света. Мы не можем исключить, что в экспериментах8,12,13возникали волновые реплики ДНК, которые искажали классическое светорассеяние для линейных полимеров. Мы не можем также исключить, что волновые реплики ДНК могут играть определенную роль в процессах волновых генетических коммуникаций между клетками в онтогенезе и во взрослом состоянии организмов.Для волновых реплик ДНК in vitro свойственен квази генетический процесс: ДНК волновым путем копирует самою себя и объекты (устройства, оборудование), вовлеченные в инициацию реплицирования (Рис. 1-3, 5 (a), (b); 6 (a), (b)). Этот момент поведения генетического аппарата in vivo у многоклеточных организмов является одним из ключевых в нашей модели волнового генома8,9,10,11. В соответствии с этой моделью, каждая клетка и вся биосистема в целом осуществляет непрерывное сканирования своего генетико-метаболического состояния. Иными словами, ДНК за счет собственных когерентных излучений in vivo поляризационно-голографическим образом19считывает самою себя и внутриклеточное метаболическое пространство в диапазоне 250-800нм, то есть копирует, создает волновые реплики своего структурно-функционального статуса в каждый момент времени. Возможно, диапазон частот гораздо шире, но технически пока возможна регистрация только указанного спектра частот. Такие реплики образуют так называемое спутанное (entanglement) состояние и нелокально (и мгновенно) информационно объединяют биосистему20.
Для формирования реплицирующихся образов на фотопленках характерны также следующие особенности:
- От кадра к кадру реплики появляются и исчезают. Например, на Рис.5: 3-й кадр – реплики есть, 4-й – исчезли; 11-й кадр – реплики есть, 12-й – исчезли. То же на 13-м и 14-м кадрах.
- Возникают реплики перфорационных отверстий и «световые засветки» (4-й кадр).
- Возникают переходы образов реплик в межкадровое пространство и даже на соседние кадры: с 13-го на 14-й и с 23 на 24-й.
Можно дать следующие предварительные объяснения этим фактам. Наблюдаемое явление перехода изображения с одного кадра на другой и засветка фотопленки в районе перфорации может быть объяснена за счет селективного выбора длины волны из широкого спектра планарными волноводами. Они образуются между верхней и нижней границами раздела толщины самого фотослоя, а также между подложкой фотопленки и ее эмульсией. При наличии многократных отражений и ввиду рассеивания на шероховатостях некачественных планарных волноводов, а также при отсутствии в них фокусировки и наложения «ползущих» отраженных изображений от противоположных границ фотопленки друг на друга, происходит взаимное их наложение с последующим их размытием. Образы перфорационных отверстий фотопленки не теряют четкости за счет относительной крупномасштабности отверстий. Крупномасштабность можно понимать как несоизмеримость размеров отверстий перфорации и размеров зерна фотоэмульсии. Крупные и высококонтрастные объекты не требуют фокусировки при трансляции изображения на малые расстояния соизмеримые с самим размером изображения. Этим же объясняется заход относительно крупномасштабных образов свечения диодов в межкадровое пространство.
Эффект нерегулярной регистрации репликаций от кадра к кадру можно понимать так: происходит относительно длительная Уф-накачка волокон препарата ДНК с его дальнейшим переизлучением после получения предельной величины запасаемой энергии. Ее излучение в течение некоторого, но гораздо меньшего времени. При несовпадении времен регистрации кадров и времени отстрела запасенной энергии накачки наблюдается пропуск регистрации реплик как самой ДНК так и окружающих предметов, а при совпадении этих времен – происходит регистрация реплик. При выборе определенного оптимального временного шага регистрации, совпадающего с временным шагом отстреливаемой энергии накачки лазерными волноводами ДНК, регистрация будет непрерывно воспроизводимой от одного кадра к каждому последующему.
Ранее мы постулировали, что ДНК in vivo-in vitro является голограммо-образующей средой8,9. Приняв это, можно полагать, что на фоточувствительной среде ДНК, как на коллагене (желатина), могут быть искусственно записаны голограммы в синем и ультрафиолетовом спектрах. В таком случае при использованном нами облучении синей и ультрафиолетовой лампами происходит одновременная авто запись препарата ДНК на самого себя и параллельная запись ближайших окружающих предметов на фоточувствительные квазицилиндрические структуры ДНК в состоянии жесткого геля. Затем с каждого из них красным и ИК- излучениями считывается множество дифракционных размытых и поэтому искаженных изображений яркого первого и, послабее, всех последующих порядков дифракционных изображений, смещенных друг относительно друга. Эта регистрация голограмм в ультрафиолете с последующим восстановлением в красном и ИК- диапазоне приводит соответственно к размытию изображений. Это размытие происходит как из-за их множественного пространственно разнесенного изображения, так и за счет содержания нескольких порядков от каждой нити волокон ДНК. Размытие происходит также и за счет собственных акустических колебаний препарата ДНК с эффектом возврата Ферми-Паста-Улама8.
Нам кажется, что подобная репликация образов при больших дозах ультрафиолетового излучения, например при солнечном ожоге, в кожных покровах и прилежащих тканях людей могут возникать патологические программы голографического ложного управления при считывании красным и ИК- диапазонами солнечного света. Это в свою очередь, при определенном последующем превышении порогового уровня яркости реконструированных голографических изображений, может привести к появлению некоторых видов злокачественных опухолей. Для меланомы это уже известно.
Помимо регистрации голограмм ввиду большой энергии ультрафиолетового облучения одновременно с регистрацией голограмм происходит эффект частичного выбивания электронов и частичного нарушения структур ДНК, скопление которых приводит к появлению свободного, типа конденсаторного заряда на поверхности ДНК-волокон. При этом накапливаемый заряд создает эффект пространственного перераспределения волокон, что в свою очередь, влияет на преимущественное распределение реконструируемых изображений. Смещение изображений, восстановленных дифракционных порядков, в сторону противоположную первоначальной дифракции обусловлено конденсаторным эффектом смены зарядового знака – минус на плюс и на оборот. При соприкосновении с таким пространственно-распределенным квазиконденсатором за счет частичной утечки и перераспределения зарядов и их взаимного расположения обнаружен новый эффект преимущественного появления правых или левых порядков дифракции в управляемых наноструктурах ДНК. Этот эффект наблюдается на Рис.5 (а, б). Этот эффект впоследствии можно будет использовать как для создания управляемых пространственных наноструктур ДНК, например, в процессах регенерации органов и тканей у людей за счет целенаправленного голографического управления, что в первичном варианте уже получено [21, 22].Мы должны подчеркнуть, что обнаруженные эффекты образования волновых реплик ДНК и ближайшего окружения нуждаются в более точной экспериментальной постановке и теоретическом обосновании. Очень многое в этой части остается неясным и поэтому исследования продолжаются.Литература
- Lolle S.J., Victor J.L., Young J.M., Pruitt R.E. Genome-wide non-mendelian inheritance of extra genomic information in Arabidopsis. Nature, 434, 505-509 (2005).
- Lagerkvist U., «Two out of Three»: an alternative method for codon reading. Proc. Natl.Acad.Sci.USA, 75, 1759 1762 (1978).
- Francis Crick. A personal View of Scientific Discovery. Basic Books, Inc., Publishers, New York. Translate into Russian: Institute of computer researches, Moscow-Ijevsk (2004), p. 98.
- Biebricher C.K., Eigen M., Luce R. Product analysis of RNA Generated de novo by Qb Replicase. J.Mol.Biol., 148, 369-390 (1981).
- Biebricher C.K., Luce R., Template-free generation of RNA species that replicate with bacteriophage T7 RNA polymerase. The EMBO Journal, 15, Issue 13, 3458-3465 (1996).
- Choudhury G.K., Kejarival P.C., Chattopadhyay A. The devices for generation of phantom leaf effect. J.Inst.Eng. (India) 60, Pt.EL3, 61-66; 67-73 (1979).
- Gariaev P.P., Junin A.M. Phantom leaf effect. Myth or reality? Energy 10, 46-52 (1989). In Russian.
- Gariaev P.P. Wave based genome. Monograph. Moscow. Ed. Obshestv. Pol’za. 279p. (1994). In Russian.
- Gariaev P.P. Wave genetic code. Monograph. Moscow. Ed. Izdatcentr. 108p. (1997). In Russian.
- Prangishvili I.V., Gariaev P.P., G.G.Tertishny, V.V.Maximenko, A.V.Mologin, E.A.Leonova, E.R.Muldashev. Spectroscopy of radiowave radiation of localized photons: path to quantum nonlocality of bioinformation processes. Sensors and systems, 9 (18), 2-13 (2000). Russian Academy of sciences. In Russian.
- Gariaev P.P., Birshtein B.I., Iarochenko A.M, Marcer P.J., George G. Tertishny G.G., Leonova E.A., Kaempf U., The DNA-wave biocomputer. «CASYS» – International Journal of Computing Anticipatory Systems (ed. D.M.Dubois), Liege, Belgium, 10, 290-310, (2001).
- Gariaev P.P., Chudin V.I., Komissarov G.G., Berezin A.A., Vasiliev A.A., Hologrphic Associative Memory of Biological Systems, Proceedings SPIE — The International Society for Optical Engineering. Optical Memory and Neural Networks, 1621, 280- 291. USA. (1991).
- Allison S.A., Sorlie S.S., Pecora R., Brownian Dynamics Simulations of Wormlike Chains, Dynamic Light Scattering from a 2311 Base Pair DNA Fragment. Macromolecules, 23, 1110-1118, (1990).
- Hagerman, P. J., and B. H. Zimm., Monte Carlo approach to the analysis of the rotational diffusion of wormlike chains. Biopolymers, 20,1481–1502, (1981).
- Zimm B H., Dynamics of polymer molecules in dilute solution: viscoelasticity, flow birefringence and dielectric loss, J. Chem. Phys., 24, 269-78, (1956). General Electric Research Laboratory, Schenectady, NY.
- Rouse P E., A theory of the linear viscoelastic properties of dilute solutions of coiling polymers, J.Chem.Phys., 21, 1272-80, (1953). Tertyshnii G.G., Gariaev P.P., Aksenov V.A., Leonova E.A., Fomchenkov S.V., The formalism of endogenous polarization/holographic managing processes in organisms. Consciousness and a physical reality, 9, number 4, 44-50 (2004). In Russian.
- Prangishvili I.V., Gariaev P.P., Tertishnii G.G., Maksimenko V.V., Mologin A.V., Leonova E.A., Muldashev E.R., Spectroscopy of radiowave radiations of the localized photons: an output on quanum nonlocal bioinformation processes. Sensors and Systems, 9 (18), 2-13 (2000). In Russian.
- Заявление о выдаче патента в Федеральный институт промышленной собственности России от 20.10.2005. Регистрационный номер 2005132403. Входящий номер 036308.
- Tertyshnii G.G., Gariaev P.P., Aksenov V.A., Leonova E.A., Fomchenkov S.V., The formalism of endogenous polarization/holographic managing processes in organisms. Consciousness and a physical reality, 9, number 4, 44-50 (2004). In Russian.
- Prangishvili I.V., Gariaev P.P., Tertishnii G.G., Maksimenko V.V., Mologin A.V., Leonova E.A., Muldashev E.R., Spectroscopy of radio wave radiations of the localized photons: an output on quanum nonlocal bioinformation processes. Sensors and Systems, (18), 2-13 (2000). In Russian.
- Гаряев П.П., Кокая А.А., Мухина И.В., Леонова-Гаряева Е.А., Кокая Н.Г.,
Влияние модулированного биоструктурами электромагнитного излучения на течение аллоксанового сахарного диабета у крыс. Бюллетень Экспериментальной Биологии и Медицины, №2, с.155-158 (2007).
- Артюх В.Д., Гаряев П.П., Кокая А.А., Леонова-Гаряева Е.А., Мулдашев Э.Р.,
Мухина И.В., Смелов М.В., Товмаш А.В., Чалкин С.Ф., Шатров Я.К., Ягужинский Л.С., 2007, Эффект лазер индуцированной устойчивости животных к аллоксану.http://www.trinitas.ru/rus/doc/0016/001b/00161365.htm
 Предыдущий пост
Предыдущий пост